


 |
 |
 |
|
Классические виды |
XX век |
|||
|
Металлы |
Электролиты |
Плазма |
Полупроводники |
Сверхпроводники |
|
электроны |
+ ионы – ионы |
+ ионы – ионы электроны |
электроны дырки ("+" частицы) |
электронные куперовские пары |
Электролиты, как и металлы, относятся к проводникам. Иногда металлы называют проводниками первого рода, а электролиты – второго рода. Будем рассматривать жидкие электролиты.
 |
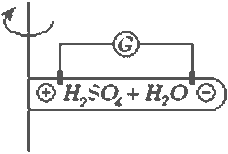
Определение: Совокупность электрохимических процессов происходящих при протекании электрического тока через электроды, погруженные в электролит, называется электролизом |
Как правило, электролиз сопровождается химическими реакциями и выделением веществ на электродах.
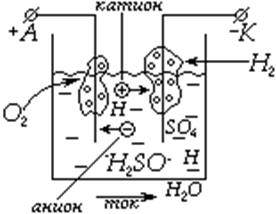
В данной ситуации происходит разложение воды на молекулярные кислород и водород, а количество H2SO4 остается неизменным.
Считается, что для электролита закон Ома выполняется. Однако для всей цепи закон Ома не выполняется из-за скачков потенциала на электродах.
Они были установлены Фарадеем в 1833 году.
Первый закон электролиза: Масса вещества, выделяющегося на электроде пропорциональна заряду, прошедшему через электролит.
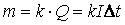
где k – электрохимический эквивалент.
|
Вещество |
|
|
Водород |
0,1045 |
|
Кислород |
0,6293 |
|
Медь |
3,24 |
|
Серебро |
11,18 |
 |
Определение: Химическим эквивалентом вещества называется отношение его молярной массы к его валентности |
Второй закон электролиза: Электрохимический эквивалент вещества пропорционален его химическому эквиваленту.
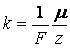
где F – постоянная Фарадея.
Часто первый и второй законы объединяют в один, который называют обобщенным законом электролиза.
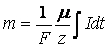
Фарадей эти законы установил экспериментально. Однако их можно получить и теоретически.

По смыслу F – это заряд моля одновалентного вещества.
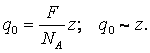
Заряд частицы-носителя тока пропорционален небольшому целому числу.
Так как постоянные Фарадея и Авогадро могут быть определены из эксперимента, то можно определить минимальный электрический заряд. Поэтому предположение о дискретности заряда было высказано задолго до Миликкена, а именно в 1881 году Гельмгольцем и Стонеем. Они же и определили его, правда, весьма приблизительно.
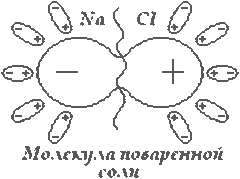
На первый взгляд должно казаться, что заряженные ионы появляются в электролите под действием электрического поля. Однако закон Джоуля – Ленца опровергает это предположение, т.к. все работа электрического тока полностью переходит в тепло, не оставляя энергии необходимой для ионизации молекул. Следовательно, нужно предположить, что распад молекулы на ионы происходит под действием растворителя. Эта гипотеза лежит в основе теории электролитической диссоциации Клаузиуса – Аррениуса. Рассмотрим это на примере водного раствора поваренной соли.
В результате взаимодействия, связь в молекуле вещества
ослабевает, и она может распасться. Косвенным доказательством этого может
служить то, что степень диссоциации зависит от диэлектрической проницаемости
растворителя. Так водный раствор (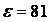 ) соли проводит ток достаточно хорошо.
Спиртовой раствор (
) соли проводит ток достаточно хорошо.
Спиртовой раствор (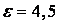 )
проводит ток значительно хуже. Существование диссоциации можно показать и экспериментально.
)
проводит ток значительно хуже. Существование диссоциации можно показать и экспериментально.
Степень диссоциации характеризуется коэффициентом диссоциации, который равен
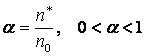
где n* -число продиссоциировавших молекул;
n0 – исходное число молекул.
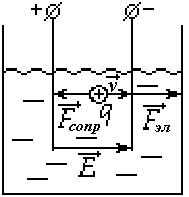
Как ранее отмечалось, заряженные частицы при протекании тока движутся с постоянной скоростью. Следовательно, на них действует сила сопротивления.
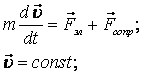

b – подвижность ионов.
|
Ион |
|
|
H+ |
+ 3,263 |
|
K+ |
+ 0,609 |
|
OH– |
– 1,802 |
|
Cl– |
– 0,667 |
Количество актов диссоциации пропорционально числу нераспавшихся молекул.
Акты диссоциации пропорциональны: 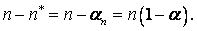
Наоборот, количество актов рекомбинации пропорционально числу тех, что продиссоциированы.
Акты рекомбинации пропорциональны: 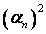 .
.
При равновесии они равны. Следовательно,
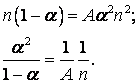
Если 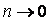 , то правая часть стремится к бесконечности.
, то правая часть стремится к бесконечности.
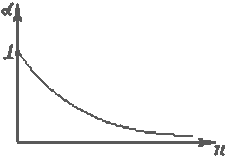
В слабом растворе степень диссоциации практически равна единице.

Таким образом, можно говорить, что электролиты подчиняются закону Ома, но с непостоянной проводимостью, т.к. степень диссоциации и подвижности сильно зависят от температуры и от электрического поля.
 |
 |
 |